行業(yè)動(dòng)態(tài)
突破性療法三年回顧:數據分析與趨勢展望
作者: 來(lái)源:神宇醫藥 日期:2015-09-09 10:15:00
醫藥網(wǎng)9月9日訊 三年前的2012年7月,FDA制訂了“突破性療法指定”,作為促進(jìn)與加快對治療嚴重病癥和未滿(mǎn)足醫療需的產(chǎn)品進(jìn)行開(kāi)發(fā)和審查的補充方案。
雖然突破性療法指定傳達了與快速通道(Fast Track)、優(yōu)先審評(Priority Review)、加速批準(Accelerated Approval)類(lèi)似的功能。不過(guò),它需要大量更優(yōu)異的的臨床改善證據,并需在整個(gè)臨床試驗過(guò)程中與FDA就開(kāi)發(fā)項目的非臨床和臨床資料、試驗設計與審評協(xié)調進(jìn)行密集溝通。
迄今,突破性療法指定已經(jīng)實(shí)施3年,其對各個(gè)藥物市場(chǎng)的競爭態(tài)勢產(chǎn)生怎樣的影響?未來(lái)前景又將如何呢?
三年數據回顧與分析
獲得突破性療法指定的熱門(mén)適應癥藥物正在減少,需尋找高度未滿(mǎn)足需求的領(lǐng)域
截至2015年6月,FDA藥品審評和研究中心(CDER)與生物制品審評和研究中心(CBER)共收到309份突破性療法指定請求。其中,29%已被授予,55%被拒絕,16%仍在等待中。該方案在過(guò)去的一年里,Ⅲ期項目的產(chǎn)品大部分已經(jīng)被授予突破性療法指定。
已披露收到突破性療法指定的72只藥品中,63%(45只)屬于腫瘤學(xué)、血液學(xué)和罕見(jiàn)疾病適應癥。在這些適應癥中,作用新穎機制一直是關(guān)注的焦點(diǎn)。另一方面,心血管疾病、免疫學(xué)和內分泌學(xué)等藥物明顯缺乏。
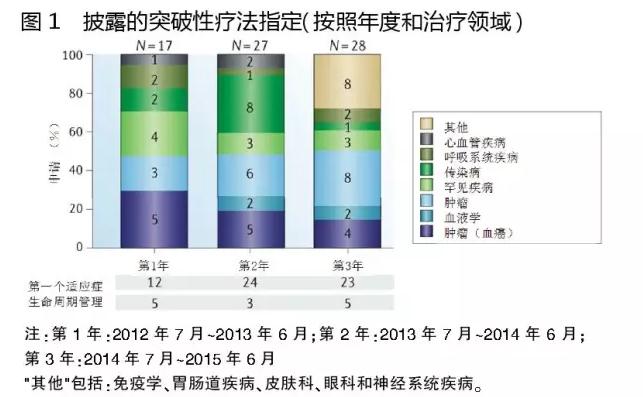
被授予突破性療法指定的優(yōu)先適應癥,包括慢性淋巴細胞白血?。–LL)、囊性纖維化、丙型肝炎病毒感染和特發(fā)性肺纖維化。但是,在這些領(lǐng)域FDA授予突破性療法指定的藥物正在減少,似乎致力于使其資源放在特別高度未滿(mǎn)足需求的領(lǐng)域。
例如,在CLL領(lǐng)域中,2013~2014年,只有4只被授予突破性療法指定的新藥隨后獲得FDA的批準,包括2只CD20特異性單克隆抗體(mAb)——葛蘭素史克的ofatumumab和羅氏的obinutuzumab,2只靶向小分子藥物——Pharmacyclics/楊森的布魯頓酪氨酸激酶抑制劑ibrutinib和吉利德公司的磷酸肌醇3-激酶δ(PI3Kδ)抑制劑idelalisib。
另一方面,對其它一些適應癥,FDA突破性療法指定的藥物開(kāi)始增加。例如,針對間變性淋巴瘤激酶(ALK)基因突變,已有幾只藥物獲得突破性療法指定,其中包括諾華的ceritinib,羅氏的alectinib和Ariad制藥公司的AP26113。
然而,Ariad制藥公司在2013年8月提出AP26113治療ALK陽(yáng)性非小細胞肺癌治療的突破性療法指定初始申請,但因“相對較短的后續行動(dòng)”和試驗中患者人群小而被拒絕。盡管AP26113已獲得有前途的數據,但并不優(yōu)于ceritinib,ceritinib曾在2013年3月被授予突破性療法指定。雖然Ariad制藥公司最終在2014年10月獲得破性療法指定,但至今仍然沒(méi)有提交新藥申請。
新藥市場(chǎng)展望的指征
是否再次獲得突破性療法指定?加速上市的情況如何?對產(chǎn)品開(kāi)發(fā)有何影響?
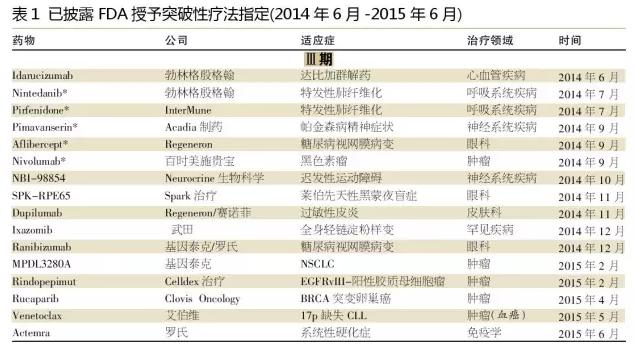
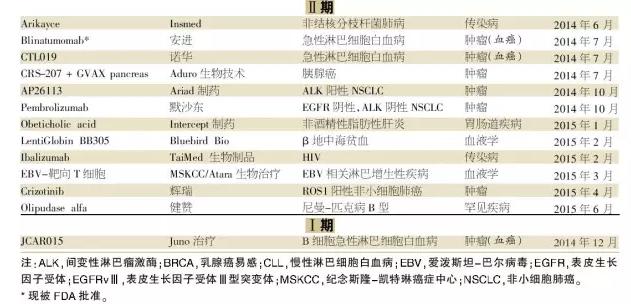
隨著(zhù)制藥公司繼續專(zhuān)注于小規?;颊呷后w的高價(jià)值機會(huì ),我們期待腫瘤學(xué)、血液學(xué)和罕見(jiàn)疾病適應癥能繼續成為未來(lái)突破性療法指定的一個(gè)主要部分。此外,我們期待更多的免疫學(xué)和中樞神經(jīng)系統藥物被授予突破性療法指定。
在高度未滿(mǎn)足臨床需求的適應癥里,藥物似乎都能被授予突破性療法指定。突破性療法指定可能被認為是一個(gè)“門(mén)檻”,在該指定狀態(tài)下雖然可有效地競爭,但不利于新藥開(kāi)發(fā)資源的分化。
然而,其他的例子表明,突破性療法指定將幫助新藥推向市場(chǎng)的速度提升,以及進(jìn)入市場(chǎng)的順序改變。到目前為止,突破性療法指定的時(shí)間效應似乎是幾個(gè)月(而非幾年),從而導致在順序項的變化相對較少。
對于已被授予突破性療法指定藥物,追隨處于早期研究階段其他適應癥會(huì )否被再次授予突破性療法指定及其時(shí)間效應,以及對產(chǎn)品開(kāi)發(fā)有什么影響,都是很有必要的。
例如,在多發(fā)性骨髓瘤領(lǐng)域,臨床開(kāi)發(fā)階段各適應癥都授予突破性療法指定新藥至今只有2只:楊森/Genmab公司的CD38特異性單克隆抗體daratumumab,以及百時(shí)美施貴寶/艾伯維的CS1特異性單克隆抗體elotuzumab。
相比之下,千年制藥/武田的蛋白酶體抑制劑ixazomib、Array生物制藥的KSP抑制劑filanesib,以及賽諾菲處于Ⅰ期的CD38特異性單克隆抗體SAR650984,還沒(méi)有披露獲得突破性療法指定。雖然這些藥物可能已經(jīng)獲得突破性療法指定,但沒(méi)有被公開(kāi)。似乎獲得突破性療法指定需要經(jīng)過(guò)時(shí)間考驗,以確定是否為高度未滿(mǎn)足需求的適應癥。
隨著(zhù)突破性療法指定對新藥進(jìn)入市場(chǎng)順序賦予的競爭優(yōu)勢,制藥公司需要仔細監控突破性療法指定在每個(gè)適應癥和治療類(lèi)別的影響。









